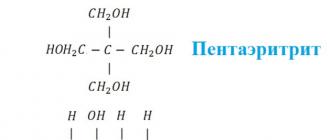Многоатомные спирты – это органические соединения, в одной молекуле которых имеется несколько гидроксильных групп. Простейшим представителем данной группы химических соединения является двухатомный , или -1,2.
Физические свойства
Данные свойства во многом зависят от строения углеводородного радикала спирта, количества гидроксильных групп, а также их положения. Таким образом, первые представители гомологического ряда – это жидкости, а высшие – это твердые вещества.
Если одноатомные спирты легко смешиваются с водой, то у многоатомных этот процесс происходит медленнее и при увеличении молекулярной массы вещества постепенно сходит на нет. За счет более сильной ассоциации молекул в подобных веществах, а значит и возникновения довольно прочных водородных связей, температура кипения спиртов высока. Диссоциация на ионы протекает в столь малой степени, что спирты дают нейтральную реакцию – окраска или фенолфталеина не изменяется.
Химические свойства
Химические свойства данных спиртов аналогичны таковым одноатомных, то есть они вступают в реакции нуклеофильного замещения, дегидратации и окисления до альдегидов или кетонов. Последнее исключено у трехатомных спиртов, окисление которых сопровождается разрушением углеводородного скелета.
Качественная реакция на многоатомные спирты проводится с гидроксидом меди (II). При добавлении индикатора в спирт, выпадает хелатный комплекс ярко-синего цвета.
Способы получения многоатомных спиртов
Синтез данных веществ возможен путем восстановления моносахаридов, а также конденсации альдегидов с в щелочной среде. Нередко многоатомные спирты получаю и из природного сырья – плодов рябины.
Наиболее употребительный многоатомный спирт – глицерин – получают путем , а с внедрением новых технологии в химическую промышленность – синтетическим способом из пропилена, образующегося в процессе крекинга нефтепродуктов.
Применение многоатомных спиртов
Области применения многоатомных спиртов различны. Эритрит используют для приготовления взрывчатых веществ, быстросохнущих красок. Ксилит широко используется в пищевой промышленности при приготовлении диабетических продуктов, а также в производстве смол, олиф и ПАВ. Из пентаэритрита получают пластификаторы для ПВХ, синтетических масел. Манит входит в состав некоторых косметических изделий. А сорбит нашел применение в медицине в качестве заменителя сахарозы.
Органические углеводороды, в молекулярной структуре которых находится две и более группы -ОН, называются многоатомными спиртами. По-другому соединения называются полиспиртами или полиолами.
Представители
В зависимости от строения выделяют двухатомные, трёхатомные, четырёхатомные и т.д. спирты. Они отличаются на одну гидроксильную группу -ОН. Общую формулу многоатомных спиртов можно записать как C n H 2 n+2 (OH) n . Однако количество атомов углерода не всегда соответствует количеству гидроксильных групп. Такое несоответствие объясняется разной структурой углеродного скелета. Например, пентаэритрит содержит пять атомов углерода и четыре группы -ОН (один углерод посередине), а сорбит - по шесть атомов углерода и групп -ОН.

Рис. 1. Структурные формулы пентаэритрита и сорбита.
В таблице описаны наиболее известные представители полиолов.
|
Вид спирта |
Название |
Формула |
Физические свойства |
|
Двухатомные (диолы) |
Этиленгликоль |
HO-CH 2 -CH 2 -OH |
Прозрачная маслянистая сильно токсичная жидкость без запаха, со сладким привкусом |
|
Трёхатомные (триолы) |
Глицерин |
Вязкая прозрачная жидкость. Смешивается с водой в любых пропорциях. Имеет сладкий вкус |
|
|
Четырёхатомные |
Пентаэритрит |
Кристаллический белый порошок со сладким вкусом. Растворяется в воде и органических растворителях |
|
|
Пятиатомные |
CH 2 OH(CHOH) 3 CH 2 OH |
Кристаллическое бесцветное вещество сладкое на вкус. Хорошо растворяется в воде, спиртах, органических кислотах |
|
|
Шестиатомные |
Сорбит (глюцит) |
Сладкое кристаллическое вещество, хорошо растворимое в воде, но плохо растворимое в этаноле |
Некоторые кристаллические многоатомные спирты, например, ксилит, сорбит, используют в качестве сахарозаменителя и пищевой добавки.

Рис. 2. Ксилит.
Получение
Полиолы получают лабораторным и промышленным путём:
- гидратацией оксида этилена (получение этиленгликоля):
С 2 Н 4 О + Н 2 О → HO-CH 2 -CH 2 -OH;
- взаимодействием галогеналканов с раствором щелочей:
R-CHCl-CH 2 Cl + 2NaOH → R-CHOH-CH 2 OH + 2NaCl;
- окислением алкенов:
R-CH=CH 2 + H 2 O + KMnO 4 → R-CHOH-CH 2 OH + MnO 2 + KOH;
- омылением жиров (получение глицерина):
C 3 H 5 (COO) 3 -R + 3NaOH → C 3 H 5 (OH) 3 + 3R-COONa

Рис. 3. Молекула глицерина.
Свойства
Химические свойства многоатомных спиртов обусловлены нахождением в молекуле нескольких гидроксильных групп. Их близкое положение способствует более лёгким разрывам водородных связей, чем у одноатомных спиртов. Многоатомные спирты проявляют кислотные и основные свойства.
Основные химические свойства описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
Со щелочными металлами |
Замещая атом водорода в группе -ОН атомом металла, образуют соли с активными металлами и их щелочами |
|
|
С галогеноводородами |
Одна из групп -ОН замещается на галоген |
HO-CH 2 -CH 2 -OH + HCl → Cl-CH 2 -CH 2 -OH (этиленхлоргидрин) + H 2 O |
|
Этерификация |
Реагируют с органическими и минеральными кислотами с образованием жиров - сложных эфиров |
C 3 H 8 O 3 + 3HNO 3 → C 3 H 5 O 3 (NO 2) 3 (нитроглицерин) + 3H 2 O |
|
Качественная реакция |
При взаимодействии с гидроксидом меди (II) в щелочной среде образуется тёмно-синий раствор |
HO-CH 2 -CH 2 -OH + Cu(OH) 2 → C 4 H 10 O 4 + 2H 2 O |
Соли двухатомных спиртов называются гликолятами, трёхатомных - глицератами.
Что мы узнали?
Из урока химии узнали, что такое многоатомные спирты или полиолы. Это углеводороды, содержащие несколько гидроксильных групп. В зависимости от количества -ОН различают двухатомные, трёхатомные, четырёхатомные, пятиатомные и т.д. спирты. Наиболее простой двухатомный спирт - этиленгликоль. Полиолы обладают сладким вкусом и хорошо растворяются в воде. Диолы и триолы - вязкие жидкости. Высшие спирты - кристаллические вещества.
Тест по теме
Оценка доклада
Средняя оценка: 4.3 . Всего получено оценок: 129.
Спирты являются производными углеводородов, в молекулах которых один или несколько атомов водорода возле насыщенного атома углерода замещен на гидроксигруппу - ОН. Экспериментально доказано, что количество гидроксилов в молекуле спирта не может превышать количество углеводородных атомов. В зависимости от природы радикала, различают ациклические (алифатического ряда) и циклические спирты; по количеству гидроксильных групп - одно-, двух-, трех- и многоатомные спирты; по насыщенности - насыщенные и ненасыщенные; месту локализации гидроксильной группы в углеводородной цепи - первичные, вторичные и третичные спирты.
Многоатомные спирты - производные алканов, в молекулах которых более трех атомов водорода замещены на гидроксигруппы - ОН. Для многоатомных спиртов как производных моносахаридов характерна оптическая изомерия и изомерия положения в углеводородной цепи ОН-группы. Оптическая изомерия связана со способностью некоторых групп органических веществ в растворах проявлять оптическую активность. Оптическая активность веществ определяется с помощью поляриметра.
На многоатомные спирты
Наиболее распространенной качественной реакцией на многоатомные спирты является их взаимодействие с В процессе реакции гидроксид растворяется, при этом образуется хелатный комплекс фиолетового цвета.
Четырехатомные спирты С4Н6(ОН)4 называются тетритами, пятиатомные С5Н7(ОН)5 - пентитами, шестиатомные спирты С6Н8(ОН)6 - гекситами. В каждой такой группе различают отдельные спирты, которые имеют исторические названия: эритрит, арабит, сорбит, ксилит, дульцит, манит и т.д.
Получение многоатомных спиртов
Эти спирты синтезируют путем восстановления моносахаридов, конденсации альдегидов с формальдегидом в щелочной среде. Очень часто многоатомные спирты получают из природного сырья. Некоторые спирты экстрагируют из плодов рябины.
Многоатомные спирты - оптически активные соединения, хорошо растворимые в воде. В ИК- и УФ-спектрах имеют полосы поглощения, типичные для ОН-групп обусловлены наличием ОН-группы. При взаимодействии этих веществ с образуются алкоголяты - сахараты. При окислении гидроксила, который локализуется возле первого атома углерода (С1) образуются моносахариды.
Многоатомные спирты: основные представители
Эритрит НОСН2(СНОН)2СН2ОН - кристаллическое вещество, плавится при 121,5 °С. Указанный спирт содержится в лишайниках и мхах. Эритрит можно получить вследствие восстановления 1,3-бутадиена и эритрозы. Указанный спирт используют при изготовлении взрывчатых соединений, быстросохнущих красок, эмульгаторов.
Ксилит НОСН2(СНОН)3СНОН - сладкие кристаллы, хорошо растворимые в воде, плавятся при температуре 61,5 градусов. Указанный спирт можно синтезировать путем восстановления ксилозы. Ксилит используется в пищевой индустрии при изготовлении продуктов питания для диабетиков, а также при производстве алкидных смол, олиф и поверхностно-активных веществ.
Пентаэритрит С(СН2ОН)4 - твердое вещество, плохо растворимое в воде. Получают при взаимодействии формальдегида с ацетальдегидом в присутствии Са(ОН)2. Используется при производстве полиэфиров, алкидных смол, тетрапентаэритрита, поверхностно-активных веществ, пластификаторов для получения поливинилхлорида, синтетических масел. Проявляет наркотические свойства.
Манит НОСН2(СНОН)4СН2ОН - сладкое на вкус вещество, плавится при температуре 165 градусов. Содержится в мхах, грибах, водорослях, высших растениях. Применяют в качестве диуретика и как компонент косметических изделий (мазей).
Д-Сорбит НОСН2(СНОН)4СН2ОН - плавится при температуре 96 градусов. Этим спиртом богаты плоды рябины. Сорбит получают при восстановлении глюкозы. Указанный спирт является промежуточным продуктом в синтезе витамина С, проявляет мочегонное действие, используется в качестве заменителя сахарозы для диабетиков.
Многоатомные спирты (полиспирты, полиолы) - органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы -OH.
Глюкоза С 6 Н 12 О 6 - моносахарид (моноза) - полифункциональное соединение, содержащее альдегидную или кетогруппу и несколько гидроксильных групп, т. е. полигидроксиальдегиды и полигидроксикетоны.
Взаимодействие многоатомных спиртов с гидроксидом меди (II)
Качественные реакции с гидроксидом меди (II) на многоатомные спирты направлены на определение их слабых кислотных свойств.
При добавлении свежеосажденного гидроксида меди (II) в сильно щелочной среде к водному раствору глицерина (HOCH 2- CH(OH)-CH 2 OH), и затем к раствору этиленгликоля (этандиолу) (HO CH 2- CH 2 OH), осадок гидроксида меди растворяется в обоих случаях и появляется ярко-синее окрашивание растворара (насыщенного цвета индиго). Это свидетельствует о кислотных свойствах глицерина и этиленгликоля.
СuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Реакция с Cu(OH) 2 - это качественная реакция на многоатомные спирты с соседними группами ОН - , что обуславливает их слабые кислотные свойства. Такую же качественную реакцию дает формалин и гидроксид меди - альдегидная группа реагирует по кислотному типу.
Качественная реакция глюкозы с гидроксидом меди (II)
Реакция глюкозы с гидроксидом меди (II) при нагревании демонстрирует восстановительные свойства глюкозы. При нагревании реакция глюкозы с гидроксидом меди(II) идет с восстановлением двухвалентной меди Cu (II) до одновалентной меди Cu (I). В начале выпадает осадок оксида меди CuO желтого цвета. В процессе дальнейшего нагревания CuO восстанавливается до оксида меди (I) – Cu 2 O, который выпадает в виде красного осадка. В процессе этой реакции глюкоза окисляется до глюконовой кислоты.
2 HOСН 2 - (СНOH) 4) - СН=O + Cu(OH) 2 = 2HOСН 2 - (СНOH) 4) - СOOH + Cu 2 O↓ + 2 H 2 O
Это качественная реакция глюкозы с гидроксидом меди на альдегидную группу.
Спирты - крупная группа органических химических веществ. Она включает подклассы одноатомных и многоатомных спиртов, а также все вещества комбинированного строения: альдегидоспирты, производные фенола, биологические молекулы. Эти вещества вступают в множество типов реакций как по гидроксильной группе, так и по атому углерода, несущему ее. Эти химические свойства спиртов следует изучить детально.
Виды спиртов
В веществах спиртов содержится гидроксильная группа, присоединенная к несущему углеродному атому. В зависимости от количества атомов углерода, с которыми соединен несущий С, спирты делятся на:
- первичные (соединенные с концевым углеродом);
- вторичные (соединены с одной гидроксильной группой, одним водородом и двумя углеродными атомами);
- третичные (соединены с тремя углеродными атомами и одной гидроксильной группой);
- смешанные (многоатомные спирты, в которых имеются гидроксильные группы у вторичных, первичных или третичных углеродных атомов).
Также спирты делятся в зависимости от количества гидроксильных радикалов на одноатомные и многоатомные. Первые содержат только одну гидроксильную группу у несущего углеродного атома, к примеру, этанол. Многоатомные спирты содержат две и более гидроксильные группы у разных несущих углеродных атомов.
Химические свойства спиртов: таблица
Наиболее удобно подать интересующий нас материал посредством таблицы, которая отражает общие принципы реакционной способности спиртов.
Реакционная связь, тип реакции | Реагент | Продукт |
Связь О-Н, замещение | Активный металл, гидрид активного металла, щелочь или амиды активных металлов | Алкоголяты |
Связь С-О и О-Н, межмолекулярная дегидратация | Спирт при нагревании в кислой среде | Простой эфир |
Связь С-О и О-Н, внутримолекулярная дегидратация | Спирт при нагревании над концентрированной серной кислотой | Непредельный углеводород |
Связь С-О, замещение | Галогеноводород, тионилхлорид, квазифосфониевая соль, галогениды фосфора | Галогеналканы |
Связь С-О - окисление | Доноры кислорода (перманганат калия) с первичным спиртом | Альдегид |
Связь С-О - окисление | Доноры кислорода (перманганат калия) с вторичным спиртом | |
Молекула спирта | Кислород (горение) | Углекислый газ и вода. |
Реакционная способность спиртов
Благодаря наличию в молекуле одноатомного спирта углеводородного радикала - связи С-О и связи О-Н - данный класс соединений вступает в многочисленные химические реакции. Они определяют химические свойства спиртов и зависят от реакционной способности вещества. Последняя, в свою очередь, зависит от длины углеводородного радикала, присоединенного у несущему углеродному атому. Чем он больше, тем ниже полярность связи О-Н, из-за чего реакции, идущие с отщеплением водорода от спирта, будет протекать медленнее. Это же снижает константу диссоциации упомянутого вещества.
Химические свойства спиртов также зависят от количества гидроксильных групп. Одна смещает электронную плотность на себя вдоль сигма-связей, что увеличивает реакционную способность по О-Н группе. Поскольку это поляризует связь С-О, то реакции с ее разрывом идут активнее у спиртов, у которых имеется две и более О-Н групп. Потому многоатомные спирты, химические свойства которых более многочисленные, охотнее вступают в реакции. Также они содержат несколько спиртовых групп, из-за чего свободно могут вступать в реакции по каждой из них.
Типичные реакции одноатомных и многоатомных спиртов
Типичные химические свойства спиртов проявляются только в реакции с активными металлами, их основаниями и гидридами, кислотами Льюиса. Также типичными являются взаимодействия с галогенводородами, галогенидами фосфора и прочими компонентами с получением галогеналканов. Также спирты являются и слабыми основаниями, потому вступают в реакции с кислотами, образуя при этом галогенводороды и сложные эфиры неорганических кислот.
Простые эфиры образуются из спиртов при межмолекулярной дегидратации. Эти же вещества вступают в реакции дегидрирования с образованием альдегидов из первичного спирта и кетонов из вторичного. Третичные спирты в подобные реакции не вступают. Также химические свойства этилового спирта (и других спиртов) оставляют возможность полного их окисления кислородом. Это простая реакция горения, сопровождающаяся выделением воды с углекислым газом и некоторого количества тепла.

Реакции по атому водорода связи О-Н
Химические свойства одноатомных спиртов допускают разрыв связи О-Н и отщепление водорода. Эти реакции протекают при взаимодействии с активными металлами и их основаниями (щелочами), с гидридами активных металлов, а также с кислотами Льюиса.

Также спирты активно вступают в реакции со стандартными органическими и неорганическими кислотами. В данном случае продуктов реакции является сложный эфир или галогенуглеводород.

Реакции синтеза галогеналканов (по связи С-О)
Галогеналканы - это типичные соединения, которые могут быть получены из спиртов при протекании нескольких типов химических реакций. В частности, химические свойства одноатомных спиртов позволяют вступать во взаимодействие с галогенводородами, с галогенидами трех- и пятивалентного фосфора, квазифосфониевыми солями, тионилхлоридом. Также галогеналканы из спиртов могут быть получены промежуточным путем, то есть синтезом алкилсульфоната, который позже вступит в реакцию замещения.
Пример первой реакции с галогенводородом указан на графическом приложении выше. Здесь бутиловый спирт реагирует с хлоридом водорода с образованием хлорбутана. В общем, класс соединений, содержащих хлор и углеводородный насыщенный радикал, называется алкилхлоридом. Побочным продуктом химического взаимодействия является вода.
Реакции с получением алкилхлорида (йодида, бромида или фторида) достаточно многочисленные. Типичный пример - взаимодействие с трибромидом фосфора, пентахлоридом фосфора и прочими соединениями данного элемента и его галогенидов, перхлоридов и перфторидов. Они протекают по механизму нуклеофильного замещения. С тионилхлоридом спирты реагируют также с образованием хлоралкана и выделением SO 2 .
Наглядно химические свойства одноатомных предельных спиртов, содержащих насыщенный углеводородный радикал, представлены в виде реакций на иллюстрации ниже.

Спирты легко взаимодействуют с квазифосфониевой солью. Однако данная реакция наиболее выгодна при протекании у одноатомных вторичных и третичных спиртов. Они региоселективны, позволяют "имплантировать" галогеновую группу в строго определенное место. Продукты таких реакций получаются с высокой массовой долей выхода. А многоатомные спирты, химические свойства которых несколько отличаются от таковых у одноатомных, могут изомеризоваться в ходе реакции. Потому получение целевого продукта затрудняется. Пример реакции на изображении.

Внутримолекулярная и межмолекулярная дегидратация спиртов
Гидроксильная группа, расположенная у несущего углеродного атома, может отщепляться при помощи сильных акцепторов. Так протекают реакции межмолекулярной дегидратации. При взаимодействии одной молекулы спирта с другой в растворе концентрированной серной кислоты молекула воды отщепляется от обеих гидроксильных групп, радикалы которых соединяются в молекулу простого эфира. При межмолекулярной дегидратации этаналя можно получить диоксан - продукт дегидратации по четырем гидроксильным группам.

При внутримолекулярной дегидратации продуктом является алкен.