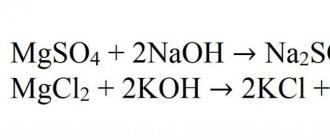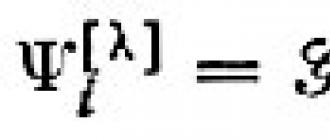Структурная формула
Русское название
Латинское название вещества Магния гидроксид
Magnesii hydroxydum (род. Magnesii hydroxydi)Брутто-формула
Mg-H 2 O 2Фармакологическая группа вещества Магния гидроксид
Нозологическая классификация (МКБ-10)
Код CAS
1309-42-8Характеристика вещества Магния гидроксид
Образуется при контакте окиси магния с водой. Магния окись — легкий, мелкий, белый порошок. Практически нерастворим в воде, растворим в разведенной соляной кислоте.
Фармакология
Фармакологическое действие - слабительное, антацидное .Нейтрализует свободную соляную кислоту желудочного сока с образованием магния хлорида. Переходя в кишечник, магния хлорид оказывает послабляющий эффект, действуя, как солевое слабительное (плохо всасывается, увеличивает осмотическое давление в просвете кишечника, способствует току жидкости по градиенту концентрации, повышает объем кишечного содержимого, растягивающего его стенки и стимулирующего перистальтику). Ионы магния выводятся с содержимым кишечника в виде малорастворимой гидроокиси и водорастворимых солей — хлорида и бикарбоната. Инактивирует пепсин и связывает желчные кислоты, попадающие в желудок в результате рефлюкса из двенадцатиперстной кишки, оказывает защитное действие на слизистую оболочку желудка и двенадцатиперстной кишки, в т.ч. при язвенной болезни желудка. В желудке расходуется не сразу и может нейтрализовать соляную кислоту, секретирующуюся через некоторое время после приема препарата, таким образом характеризуется быстрым и длительным антацидным эффектом, который не сопровождается вторичной гиперсекрецией соляной кислоты и изменениями КЩС . Способствует повышению перистальтики всех отделов кишечника. Слабительное действие наступает через 0,5-6 ч. При использовании у пациентов с нарушениями функции почек возможно всасывание в кровь небольшого количества магния и развитие токсических реакций, проявляющихся угнетением ЦНС .
Применение вещества Магния гидроксид
Хронический гастрит с нормальной и повышенной секрецией (в фазе обострения), язвенная болезнь желудка и двенадцатиперстной кишки, дискомфорт или боли в эпигастрии, изжога после погрешностей в питании, употребления кофе, алкоголя, курения, запоры.
Противопоказания
Гиперчувствительность, детский возраст (до 3 лет, для таблеток — до 6 лет).
Побочные действия вещества Магния гидроксид
Угнетение ЦНС (если по каким-либо причинам имела место абсорбция магния), аллергические реакции.
Гидроксид магния - это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния - Mg(OH) 2 , то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы - большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.
Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит - уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Получение
Основная реакция получения нерастворимых гидроксидов - это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример - при взаимодействии хлорида магния и гидроксида калия.

В ионном виде все подобные реакции записываются как:
Mg 2+ + OH - → Mg(OH) 2
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.

Существует такой достаточно распространенный минерал - доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
MgCO 3 ·CaCO 3 + 2H 2 O + MgCl 2 → Mg(OH) 2 + CaCl 2 + 2CO 2
Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480 o C разлагается на оксид магния и воду, как и любое другое нерастворимое основание. Плотность при нормальных условиях: 2,4 г/см 3 .
Химические свойства
Гидроксид магния - типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:

Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:

Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Mg(OH) 2 → H 2 O + MgO
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Mg(OH) 2 + 2NaOH → Na 2
Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения - расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид - довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
Гидроксид магния - это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния - Mg(OH)2, то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы - большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.
Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит - уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Получение
Основная реакция получения нерастворимых гидроксидов - это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример - при взаимодействии хлорида магния и гидроксида калия.

В ионном виде все подобные реакции записываются как:
Mg2+ + OH- → Mg(OH)2
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.

Существует такой достаточно распространенный минерал - доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
MgCO3·CaCO3 + 2H2O + MgCl2 → Mg(OH)2 + CaCl2 + 2CO2
Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480 oC разлагается на оксид магния и воду, как и любое другое нерастворимое основание. Плотность при нормальных условиях: 2,4 г/см3.
Химические свойства
Гидроксид магния - типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:

Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:

Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Mg(OH)2 → H2O + MgO
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Mg(OH)2 + 2NaOH → Na2
Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения - расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид - довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
ОПРЕДЕЛЕНИЕ
Гидроксид магния в обычных условиях представляет собой твердое вещество белого цвета (рис. 1) кристаллической структуры разлагающееся при нагревании.
Не растворяется в воде. Проявляет основные свойства, реагирует с кислотами, кислотными оксидами. В жестких условиях образует гидроксокомплексы. Поглощает углекислый газ из воздуха. Переводится в раствор солями аммония.
Рис. 1. Гидроксид магния. Внешний вид.
Химическая формула гидроксида магния
Химическая формула гидроксида магния Mg(OH) 2 . Она показывает, что в состав данной молекулы входят один атом магния (Ar = 24 а.е.м.), два атома кислорода (Ar = 16 а.е.м.) и два атома водорода (Ar= 1 а.е.м.). По химической формуле можно вычислить молекулярную массу гидроксида магния:
Mr(Mg(OH) 2) = Ar(Mg) + 2×Ar(H) + 2×Ar(O);
Mr(Mg(OH) 2) = 24 + 2×1 + 2×16 = 24 + 2 + 32 = 58.
Структурная (графическая) формула гидроксида магния
Структурная (графическая) формула гидроксида магния является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
H - O - Mg - O — H .
Ионная формула
Гидроксид магния представляет собой электролит, который диссоциирует на ионы в водном растворе согласно следующему уравнению реакции:
Mg(OH) 2 ↔ Mg 2+ + 2OH — .
Примеры решения задач
ПРИМЕР 1
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде:
C n H 2n+1 COOH + NaHCO 3 → C n H 2n+1 COONa + CO 2 + H 2 O. Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа: n(CO 2) = V(CO 2) / V m ; n(CO 2) = 5,6 / 22,4 = 0,25 моль. Согласно уравнению реакции n(CO 2): n(C n H 2n+1 COOH) = 1:1, т.е. n(C n H 2n+1 COOH) = n(CO 2) = 0,25 моль. Рассчитаем молярную массу предельной одноосновной кислоты: M(C n H 2n+1 COOH) = m(C n H 2n+1 COOH) / n(C n H 2n+1 COOH); M(C n H 2 n +1 COOH) = 25,5 / 0,25 = 102 г/моль. Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 - для углерода, 1 - для водорода и 16 для кислорода): M(C n H 2n+1 COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46; 14n + 46 = 102 г/моль; Значит молекулярная формула предельной одноосновной кислоты C 4 H 9 COOH. |
| Ответ | C 4 H 9 COOH |
ПРИМЕР 2
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде:
C n H 2 n + HCl → C n H 2 n +1 Cl. Рассчитаем количество вещества хлороводорода: n(HCl) = V(HCl) / V m ; n(HCl) = 1,2 / 22,4 = 0,05 моль. Согласно уравнению реакции n(HCl): n(C n H 2n) = 1:1, т.е. n(C n H 2n) = n(HCl) = 0,05 моль. Рассчитаем молярную массу алкена: M(C n H 2n) = m(C n H 2n) / n(C n H 2n); M(C n H 2 n) = 2,8 / 0,05 = 56 г/моль. Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 - для углерода и 1 - для водорода): M(C n H 2 n) = 12n + 2n = 14n; 14n= 56 г/моль; Значит молекулярная формула алкена C 4 H 8 . |
| Ответ | C 4 H 8 |
Гидроксид магния (е528) – пищевая добавка группы эмульгаторов.
Характеристика
Внешне химическое соединение представляет собой кристаллический порошок белого цвета, без запаха, с характерным вкусом щелочи. Применяют е528 в качестве пищевой добавки. Основное ее предназначение – стабилизация оттенков продуктов и регуляция кислотности.
При температуре 350 градусов по Цельсию гидроксид магния разлагается на воду и оксид магния. В воде практически не растворяется. Из воздуха поглощает углекислый газ и воду, при этом образуя основной карбонат магния. В природе е528 можно встретить в виде особого минерала – брусита.
Получение гидроксида магния
В промышленных масштабах получение гидроксида магния происходит посредством взаимодействия солей магния с различными щелочами.
Также химическое соединение получают путем реакции раствора магния хлорида с обожженным доломитом, либо при взаимодействии паров воды с металлическим магнием.
Свойства гидроксида магния
В пищевой промышленности свойства гидроксида магния получили распространение при изготовлении продуктов из какао (до 70 г/кг), консервированных овощей (соленые и квашеные овощи, соусы, маринады, овощные закусочные консервы, овощные натуральные консервы), сыра. В качестве пищевой добавки е528 применяют для связывания диоксида серы.
Используют вещество в качестве флокулянта для очистки сточных вод, в качестве добавки в различные моющие средства, антиперспиранты, дезодоранты и зубную пасту. Применяют для рафинирования сахара и получения оксида магния.
Отдельного внимания заслуживают свойства гидроксида магния, позволяющие использовать его в медицине. Вещество оказывает антацидное и слабительное действие, снижает активность желудочного сока и нейтрализует соляную кислоту в желудке. При этом, применение е528 не сопровождается изменения КЩР или вторичной гиперсекрецией соляной кислоты. Также в медицине вещество используют для повышения перистальтики кишечника. В качестве слабительного начинает действовать спустя 2-6 часов после применения.
 Показания к применению химического соединения: изжога после употребления кофе, алкоголя или курения, хронический гастрит с нормальной или повышенной секрецией, язва желудка и 12-перстной кишки, запоры, боли в эпигастрии и чувство дискомфорта.
Показания к применению химического соединения: изжога после употребления кофе, алкоголя или курения, хронический гастрит с нормальной или повышенной секрецией, язва желудка и 12-перстной кишки, запоры, боли в эпигастрии и чувство дискомфорта.
В медицине получил распространения алгелдрат магния гидроксид – средство, которое используют при остром дуодените, язве желудка, гастралгии, изжоге, хроническом панкреатите, бродильной или гнилостной диспепсии, гиперацидном гастрите. Однако, следует знать, что этот препарат противопоказан пациентам с гиперчувствительностью к гидроксиду магния, при болезни Альцгеймера и в период беременности и лактации. С осторожностью следует применять его пациентам, имеющим проблемы с почками, так как после его применения может развиться избыток магния в организме (гипермагниемия).
Влияние на организм человека
Пищевая добавка е528 запрещена в Австралии, Великобритании, Новой Зеландии. Вообще, добавка для организма считается безвредной. Однако ее употребление в больших концентрациях может спровоцировать расстройство желудка и вызвать понос, так как она всасывает жидкость из кишечника, усиливая его моторику.